آیا اسید فسفر برای بدن بد است؟
همیشه در فهرست عناصر موجود در سودا مورد علاقه خود نگاه کنید احتمالا، اسید فسفریک خوراکی را مشاهده خواهید کرد. این یک افزودنی معمول در بسیاری از غذاهای فرآوری شده است. تولید کنندگان از آن برای اضافه کردن طعم استفاده می کنند.
اسید فسفریک چیست؟
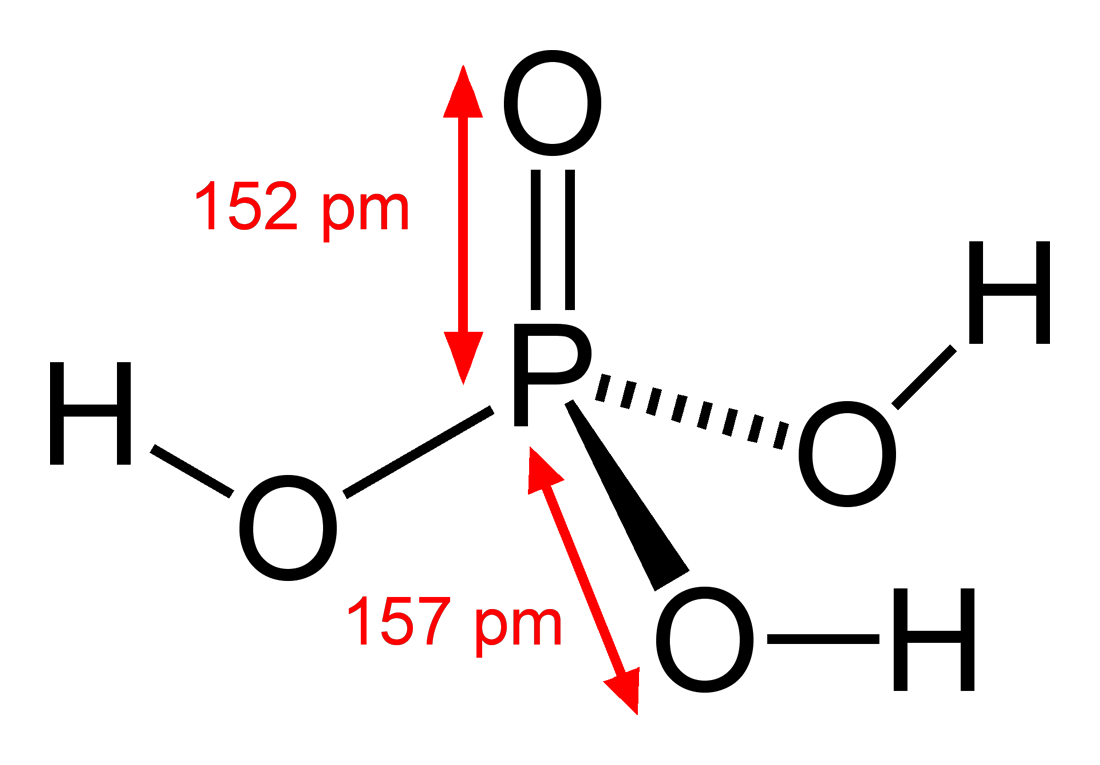
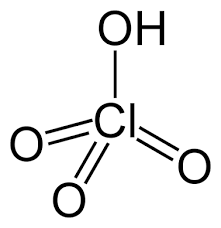
اسید فسفریک یک مایع بلورین بی رنگ و بی بو است. به نوشیدنی ها طعم لایه ای می دهد و از رشد قالب و باکتری ها جلوگیری می کند، که می تواند به راحتی در یک محلول شیرین، ضرب شود. اکثر اسیدیته سودا نیز از اسید فسفریک می آید.
اسید فسفریک از فسفر معدنی ساخته شده است که به طور طبیعی در بدن یافت می شود. مانند کلسیم می باشد تا استخوان ها و دندان های قوی ایجاد کند. همچنین کمک می کند تا از عملکرد کلیه و نحوه ذخیره انرژی حمایت کند. فسفر پس از تمرین سخت، عضلات شما را بهبود می بخشد. این ماده معدنی نقش مهمی در رشد بدن دارد و حتی برای تولید DNA و RNA، کدهای ژنتیکی موجودات زنده مورد نیاز است.
فسفر اول از طریق یک فرآیند تولید شیمیایی به پنتوکسید فسفر تبدیل می شود. پس از آن دوباره به اسید فسفریک تبدیل می شود .
خطرات احتمالی
در واقع فسفر بیش از اندازه کافی نیست. فسفر به طور طبیعی در بسیاری از غذاها یافت می شود و اسید فسفریک به عنوان یک افزودنی استفاده می شود، بنابراین اکثر مردم در رژیم غذایی خود به اندازه کافی دریافت می کنند.
بدن شما نیاز به فسفر دارد، اما بیش از حد از آن می تواند مشکلات ایجاد کند.مصرف فسفر بیش از حد می تواند شما را در معرض خطر پوکی استخوان و بیماری های قلبی قرار دهد. کلسیم و فسفر با یکدیگر برای ایجاد و حفظ دندان ها و استخوان های سالم کار می کنند. برای موثر بودن مواد معدنی باید متعادل باشد.
فسفر بیش از حد می تواند میزان کلسیم بدن شما را کاهش دهد و منجر به از دست رفتن استخوان شود. همچنین می تواند توانایی بدن شما برای استفاده از سایر مواد معدنی مانند آهن، روی و منیزیم را مختل کند.
اسید فسفریک خطرناک است اگر با آن به عنوان یک ماده شیمیایی تماس بگیرید. گازهای سمی می تواند پوست، چشم و سیستم تنفسی شما را تحریک کند.
ایمنی
مقدار روزانه توصیه شده (RDA) فسفر مورد نیاز برای عملکرد طبیعی بدن 700 میلی گرم است. شما می توانید این را به راحتی از منابع غذایی طبیعی دریافت کنید. غذاهایی با پروتئین بالا (مثلا گوشت، لوبیا، تخم مرغ، مرغ و ماهی) معمولا فسفر زیاد دارد. این به این معنی است که اسید فسفریک خوراکی در غذاهای فرآوری شده و سودا بیشتر از نیاز بدن ما است.
از آنجایی که بسیاری از ما از نوشیدنی ها زیاد استفاده می کنیم و غذاهای فرآوری شده را می خوریم، بعضی از متخصصان بهداشت در مورد رژیم غذایی در مورد اسید فسفریک نگران هستند. به عنوان مثال، یک نوشابه ممکن است تا 500 میلی گرم اسید فسفریک داشته باشد. افرادی که 4000 میلی گرم در روز فسفر مصرف می کنند در معرض خطر بالای اثرات منفی سلامتی مرتبط با فسفر قرار می گیرند.
به بزرگسالان مبتلا به بیماری کلیوی توصیه می شود که روزانه بیش از 800 تا 1000 میلی گرم فسفر نداشته باشند. کلیه ها به بدن کمک می کنند فسفر اضافی را از بین ببرند اما اگر زیاد مصرف شوند فسفر زیاد می تواند در خون ایجاد شود.